编者按:跟随声音的电波,走进学术的殿堂。《肿瘤瞭望》推出全新栏目“瞭望FM”,将邀请国内肿瘤名家,通过音频解说、图文总结的形式,带领读者全方位解读肿瘤研究新进展及热点话题。本期活动中,大连医科大学第二附属医院的王嘉教授为我们解析了AACR2020大会上两项PARP抑制剂单药或联合用药相关研究。

EMBRACA研究是一项用Tarazoparib(TALA)治疗胚系BRCA1/2突变(gBRCA1/2m)HER2-晚期乳腺癌的、开放的、全球多中心的随机对照III期临床试验。这项研究的目的是要对比PARP抑制剂TALA和临床医生选择的化疗方案治疗gBRCA1/2m的局部晚期或转移性乳腺癌的疗效以及安全性。
我们知道PARP抑制剂是一种利用DNA损伤修复障碍原理的新型靶向药物。这类药物目前有奥拉帕利、维拉帕利、尼拉帕利、卢卡帕利以及EMBRACA研究中介绍的他拉唑帕利(Tarazoparib,TALA)。TALA由于其不仅可抑制PARP的催化活性,最重要的是可以强效捕获单链DNA断裂位点的PARP-DNA复合体,是目前最为高效能的PARP抑制剂。
回溯其研发历史,2011年实体瘤的I期临床试验显示TALA单药对于BRCA突变乳腺癌可以观察到确实的临床获益,同时明确了推荐剂量,不良反应主要为贫血、疲劳等,且安全可控。在II期临床研究ABRAZO中,TALA治疗曾接受过铂类治疗的患者也可得到21%的ORR,治疗曾接受过三线及以上非铂类化疗的患者ORR可达37%。
从2018年起,多个国际会议及期刊杂志上报道的EMBRACA试验结果都备受瞩目。2018年3月发表于NEJM的中期分析结果显示:1、在主要研究终点无进展生存(PFS)方面,单药TALA显著优于对照组,PFS由5.6个月延长到8.6个月,统计学差异显著(见下图);2、总生存OS没有表现出统计学差异;3、TALA组的生活质量及总体健康状况优于对照组。正是基于此结果,美国FDA随后批准其进入临床使用,2019年的NCCN指南也将TALA,I级推荐为治疗HER-、gBRCA1/2m的晚期患者。随后的2019年ASCO会议上关于EMBRACA研究中化疗线数的分析显示无论在0线、1线还是超过1线,TALA都显示出PFS和ORR的获益,这种获益在HR+和TNBC亚组都可看得到。后续EMBRACA研究组又分别公布了美国以及亚洲人种的亚组分析结果,在美国或是亚洲的结果与整体获益情况是一致的。
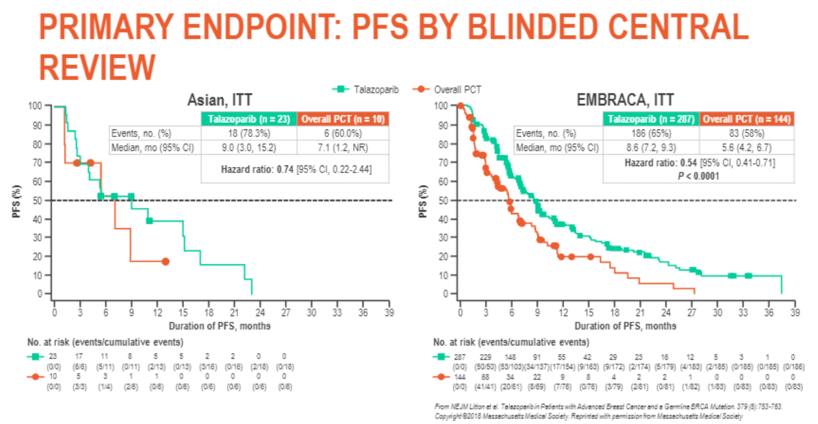
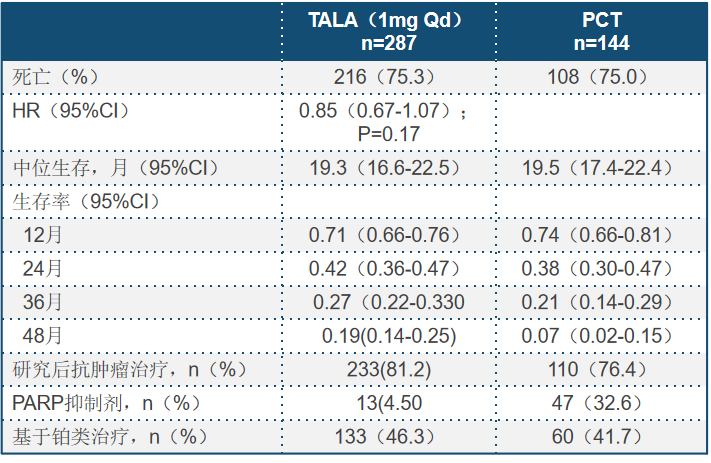
本次AACR大会上Jennifer教授公布了次要终点OS的最终结果。OS在TALA组合化疗组分别为44.9个月和36.8个月。尽管没有得到统计学上差异,但TALA组的24、36、48个月的OS率都高于化疗组(见下表),而且更重要的是,无论既往是否使用过铂类,无论激素受体状态,都可以看到TALA获益更近明显。分析OS没有得到统计学上差异的原因,随后又接受了PARP抑制剂或铂类疗法的患者在化疗组有近60%,而TALA组却不到50%。也就是说化疗组中约有三分之一的患者接受了后续的PARP抑制剂,而接受TALA治疗的患者只占4.5%,后续治疗可能是造成影响OS的潜在原因。2次敏感性分析也说明随后的PARP抑制剂以及含或不含铂类药物的治疗低估了TALA对OS获益效力。另外本次研究还对长期随访的生活质量调查做了更新,结果可以看到,TALA组的生活质量和总体健康状况都要好于对照组,至临床恶化时间也明显延长且有统计学差异。另外一个有趣的发现是,通过对70%左右患者的原发或转移部位肿瘤测序发现,83%的患者存在BRCA-LOH,即BRCA杂合损失,但有无缺失并没有影响TALA带来的生存获益。
表1.OS和研究后治疗(意向治疗)
小结:综合上述试验结果来看,类似TALA这样的PARP抑制剂在BRCA突变的TNBC甚至高危的HR+患者的晚期治疗中的获益毋庸置疑。坚定了我们除了ER、HER2外,对另外一个靶向分子---BRCA的靶向治疗的信心。但依然有很多挑战是我们必须面对的,例如:1. 同源重组修复障碍中除了BRCA外的其它生物标记物;2. PARP抑制剂与其它药物合用的问题;3. PARP抑制剂耐药后的用药方案;4. 新辅助治疗领域的用药适应人群和先后顺序等。
I-SPY 2研究:PARPi+免疫+化疗新辅助治疗及标志物探索
理论上来讲,DNA损伤引起免疫源性物质的产生和堆积,STING等通路被激活;同时动物实验证明PARP抑制剂也可引起组织中PD-L1的表达上调,激活免疫内环境。所以PARP抑制剂联合免疫治疗应该是一种值得探索的组合方案。同时有临床试验表明奥拉帕利联合紫衫类药物是可以耐受的。
I-SPY 2是一种适应性研究方法。简单讲可以用三个“新”来形象地对这种试验设计的思维做出轮廓的勾勒,即“新”药组合,“新”辅助治疗平台,“新”生物标记物的探索。利用高贝叶斯预测概率的方法从试验中获得相应的对比信息,从而快速推进更大样本的III期临床试验设计是它的目的。这种设计方案快速、高效,具有“船小好调头”的优势。
本次会议Yale癌症中心的Puszutai教授最新发布了一组数据。对于HER2阴性的II期或III期、肿瘤大于等于2.5cm、Mammaprint高危患者,进行DOP(PD-L1单抗Durvalumab +PARP抑制剂奥拉帕利+紫杉醇)组合的尝试,对比周疗紫衫单药,两组都在术前序贯AC四个周期,主要终点依然是pCR率。试验结果显示,在总HER2-人群中与对照组相比pCR率从20%提高到37%,在三阴性乳腺癌亚组中pCR率从27%提高到47%,HER2-/HR+亚组中从14%增加到28%。而且DOP组合不仅增加了pCR率,试验组中未达到pCR者也取得了更小的残余病灶的疗效。不良事件的发生率在试验组为58%,对照组为41%。III级免疫相关不良反应发生率在试验组为19%,对照组1.6%。
同时,对于联合用药的biomarker的探索,在三阴性亚组中,可以看到低CD3/CD8基因特征比率、高巨噬细胞/T细胞组织相容性复合体class II基因特征比率、高增殖特征者pCR率高,但BRCA突变、肿瘤突变负荷、PD-L1蛋白表达分析将在后续会议中报告。
小结:通过此项研究,我们注意到免疫调节点抑制剂与PARP抑制剂联合紫衫的用药组合极大的提高了II期III期高危HER2-者的pCR率。是一种极具前景的用药组合,并且在HR+和TNBC人群中都可看到pCR率的提高,对Mammaprint高危患者不失为一种优秀的选择方案,后续的有关biomarker的临床研究结果非常值得期待。
医学博士/博士后,副主任医师,副教授,硕士生导师
大连医科大学附属第二医院乳腺疾病研究中心副主任
中华医学会肿瘤学分会乳腺学组青委会委员
中国妇幼保健协会青委会委员
中国医药教育协会乳腺病专业委员会乳腺癌多学科诊疗学组委员
中国康复医学会修复重建外科专业委员会美容外科分会委员
JCO中文版青年编委
全球卫生部后备人才库
辽宁省细胞生物学学会乳腺肿瘤精准治疗与临床科研专业委员会副主任委员
辽宁省生命科学学会乳腺疾病微创诊断及治疗专业委员会青委会副主任委员





 京公网安备 11010502033352号
京公网安备 11010502033352号