导读:TNBC占所有乳腺癌患者的15-20%,且与发病年龄早、侵袭性强和预后差相关。TNBC患者的治疗手段有限,近年来的临床探索也为TNBC患者增加了治疗选择,尤其是免疫治疗的进展为TNBC乳腺癌开启了新的治疗篇章,但依然有很多问题需要开放性的讨论。
在过去的10多年的探索里,多项证据提示了免疫系统对于TNBC病程影响的主要作用,乳腺浸润淋巴细胞的存在被认为是TNBC在辅助和新辅助治疗中预后良好的预测因子。另外,CD8+TILs数量多或者CD8+/FOXP3+比例高,能够识别新辅助化疗预后好的TNBC患者。随着肿瘤浸润淋巴细胞 (tumor-infiltrating lymphocytes;TILs)的出现,免疫逃逸分子比如PD-L1的表达也被发现影响TNBC的预后,以上研究的发现也促成了PD-1和PD-L1抗体的出现,为TNBC患者的免疫治疗提供了思路和基础[1,2]。
虽然免疫治疗带来了TNBC领域令人振奋的结果,但是也引发了更多临床的思考:免疫治疗是否真的会为晚期TNBC患者的治疗带来变革?免疫治疗在早期新辅助的作用将会如何?如何评估PD-L1阳性肿瘤从免疫治疗的获益?PD-L1表达是检测在免疫细胞还是肿瘤细胞?免疫治疗最理想的化疗药物配伍是什么? 免疫单药是否是某些特定人群的优效选择?
多项研究提示TNBC的免疫治疗需要筛选优势人群;但是在多种肿瘤中发现除了PD-L1阳性、PD-L1阴性的患者同样可以从免疫治疗中获益[3],因此提示PD-L1并不是PD-1/PD-L1抑制剂理想的筛选指标;因此免疫治疗未来可能需要考虑患者和肿瘤的综合情况基于多个参数来选择优势人群。此外考虑到免疫治疗的毒性以及不同肿瘤之间有效率的差异,以及免疫治疗给患者带来的经济压力,临床迫切需要能够识别免疫治疗的有效标记物。
TNBC患者中PD-L1阳性表达占40-65%[4],PD-L1在肿瘤细胞和/或肿瘤免疫细胞的表达在一些研究中被认为是有效识别对PD-1和PD-L1抑制剂有效的标记物。尽管如此,对于技术的检测依然有很多问题需要解决,比如PD-L1在肿瘤细胞/肿瘤免疫细胞表达的异质性、表达的动态性变化,以及对预后和预测的意义。而且多项研究发现PD-L1阴性的患者依然对免疫治疗有效;因此对于乳腺癌的免疫治疗优势人群的筛选,除了PD-L1表达,还需要寻找其他的标记物,如基因测序、TILs、TMB、MSI和MMR的缺失等。
1.2肿瘤浸润淋巴细胞
(Tumor-infiltrating lymphocytes, TILs)
TILs除了可预测早期TNBC患者在接受新辅助化疗后的患者生存和pCR率外,对于免疫制剂单药的疗效也有预测作用,且对其的评估已经做为免疫治疗临床研究中分层特征。据报道,CD8+ TILs(伴随有免疫细胞PD-L1表达)证实与Impassion130研究中阿特珠单抗联合白蛋白紫杉醇与PFS和OS的延长相关[3]。而在KEYNOTE-173研究[5]中探讨的帕博利珠单抗联合化疗在新辅助TNBC研究中,发现基质的TILs仅能够预测PFS获益。另外一项研究发现,基质TILs和PD-L1高表达,进行联合的评分,能够显著的改善TNBC患者免疫联合治疗的pCR率和ORR。
1.3 肿瘤突变负荷
(Tumor mutational burden,TMB)
在黑色素瘤、肺癌和结直肠癌中发现TMB-H与免疫制剂疗效相关,但是TMB在乳腺癌中的报道有限,研究发现在TNBC患者中TMB-H比例较HR+乳腺癌高[6];但是TMB-H的cutoff值还存在争议,以及TMB-H在乳腺癌中对免疫治疗的敏感性、TMB是否可以成为乳腺癌免疫疗效预测的合适标记物需要进一步的研究证实。
微卫星不稳定(MSI)是指DNA错配修复(MMR)功能出现异常时,微卫星出现的复制错误得不到纠正并不断累积,使得微卫星序列长度或碱基组成发生改变的现象。研究发现MSI-H的肿瘤容易对免疫治疗有响应,因此帕博利珠单抗获批了MSI-H或者MMR缺失的不可切除或转移性实体瘤的适应症;MSI在乳腺癌的发病率并未被完全阐明,据现有报道可能<2%;在一项超1900例乳腺癌的分析中[7],MSI-H发生率为0.6%;此外BRCA突变在同源重组介导的DNA修复起到重要作用,其中 BRCA1突变倾向于TNBC患者,突变比高达40%-50%;BRCA1突变的TNBC和野生型TNBC相比,具有更高的体细胞突变负荷、更多的TILs以及PD-1和CTLA-4的表达增加。有趣的是,两种免疫治疗联合(抗PD-1和抗CTLA-4)以及顺铂在BRCA1缺失的TNBC模型中可以降低肿瘤生长及提高生存,因此BRCA1突变的TNBC患者提供了新的免疫治疗的思路,此外关于免疫治疗联合PARP抑制剂的治疗方案也在TNBC中探索。
Impassion130研究[3]中选择了白蛋白紫杉醇,因为其有利于降低糖皮质激素的使用;但是从增强疗效的角度来说,可以选择蒽环、铂类或者其他紫杉类药物。化疗可以诱导肿瘤微环境中多种免疫调节的改变,包括免疫细胞抗原释放增加、PD-L1表达上调以及细胞表面标记的免疫原性高表达,以上改变将会积极参与到影响免疫治疗的疗效中,具体的讲,TNBC治疗常规使用的各种化疗药物可引起明显的免疫系统作用。
蒽环类药物能够诱导免疫原性细胞死亡,通过激活树突和特定T细胞反应诱导细胞凋亡,且可以引起CD8+T细胞增殖增加。紫杉类药物可以增加原发性乳腺癌中TIL的招募,而且紫杉类药物可选择性降低T调节和骨髓来源的抑制细胞(myeloid-derived suppressor cells, MDSCs);部分降低肿瘤微环境中免疫抑制,但是目前没有临床前数据关于白蛋白紫杉醇对于免疫系统的影响报道。吉西他滨可以减少髓系抑制细胞(Myeloid derived suppressor cells,MDSC)数量并增加CD8+T细胞的抗肿瘤活性。因此关于免疫治疗最佳的化疗配伍,需要平衡疗效、机制和不良反应进一步探索。
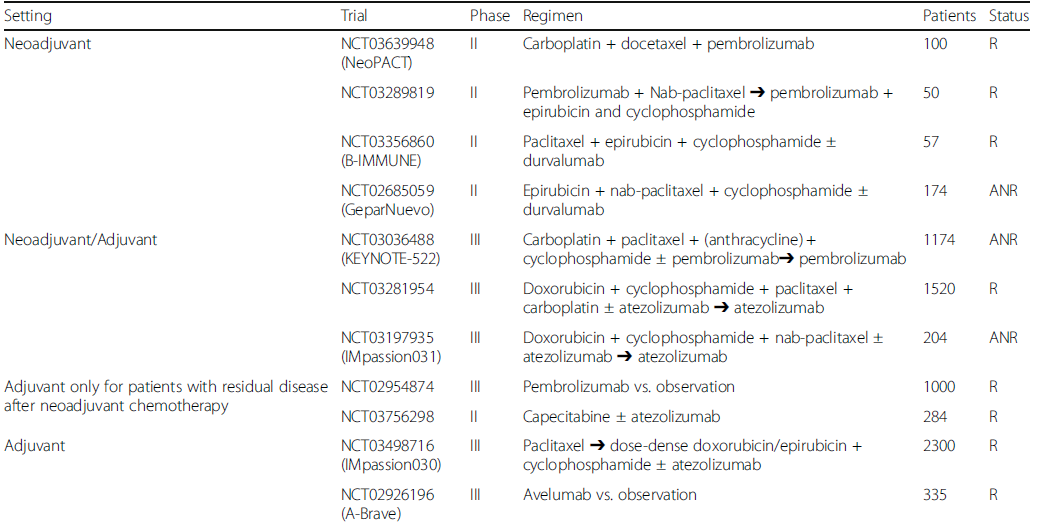
免疫治疗在晚期肿瘤的进展,也引起了大家对于免疫治疗在辅助和新辅助阶段的尝试和探索的兴趣;免疫治疗在Ⅲ期黑色素瘤和非小细胞肺癌中的得到阳性的结果,在TNBC患者中,有不同种类的关于新辅助的探索正在进行中[表1];在体内的临床前研究也探索了免疫治疗和其他药物的联合,如化疗、靶向药物及其他免疫制剂;但是关于新辅助免疫治疗中有个问题必须引起重视:OS和DFS是否应该成为新辅助免疫治疗的替代pCR的终点?在其他实体瘤中,免疫治疗的真实获益往往体现在OS的延长;因此pCR可能并不是新辅助治疗阶段的最理想替代终点;强烈建议在未来的TNBC新辅助免疫临床研究中探索合适的研究终点。考虑到辅助治疗,对于新辅助化疗后未达到pCR的TNBC患者预后差,标准治疗联合免疫治疗也许是未来的探索方向。
基于免疫检查点抑制剂改变了多个肿瘤的治疗路径;免疫治疗在乳腺癌的治疗也开启了新的篇章,有改变临床实践的进展,也有需要进一步解决的问题,期待TNBC的领域中能够出现更多改变临床格局的治疗方案。
表1 正在进行的免疫治疗在早期TNBC的研究
[1] Patel SP, Kurzrock R. PD-L1 expression as a predictive biomarker in cancer immunotherapy. Mol Cancer Ther. 2015;14:847–56.[2] Gibney GT, Weiner LM, Atkins MB. Predictive biomarkers for checkpoint inhibitor-based immunotherapy. Lancet Oncol. 2016;17:e542–51.[3] Ribas A, Hu-Lieskovan S. What does PD-L1 positive or negative mean? J Exp Med. 2016;213:2835–40.[4] Kwa MJ, Adams S. Checkpoint inhibitors in triple-negative breast cancer (TNBC): where to go from here. Cancer. 2018;124:2086–103.[5] Loi S, Schmid P, Cortés J, et al. Relationship between tumor infiltrating lymphocytes (TILs) and response to pembrolizumab (Pembro)+chemotherapy (Chemo) as neoadjuvant treatment (NAT) for triple-negative breast cancer (TNBC): phase Ib KEYNOTE-173 trial. Proceedings of the 2018San Antonio Breast Cancer Symposium; 2018 Dec 4-8; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2019;79(4 Suppl):Abstract nr P3-10-09.[6] Thomas A, Routh ED, Pullikuth A, et al. Tumor mutational burden is a determinant of immune-mediated survival in breast cancer. Oncoimmunology. 2018;7:e1490854.[7] Obeid E, Ellerbrock A, Handorf E et al. Distribution of microsatellite instability, tumor mutational load, and PD-L1 status in molecularly profiled invasive breast cancer. Proceedings of the 2017 San Antonio Breast Cancer Symposium; 2017 Dec 5-9; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2018;78(4 Suppl):Abstract nr PD6-03.[8] Antonio M, Giulia V, Giuseppe C, et al. Recent advances in triple negative breast cancer: the immunotherapy era. BMC Med. 2019 May 9;17(1):90
 ?
?
主任医师
吉林省肿瘤医院乳腺二科主任
吉林省抗癌协会乳腺癌专业委员会副主任委员
吉林省抗癌协会乳腺癌专业委员会青委会主任委员
中国临床肿瘤学(CSCO)乳腺癌专业委员会委员
中国医师协会肿瘤医师分会第二届委员会乳腺癌学组委员
中国医疗保健国际交流促进会乳腺疾病分会青年委员会委员
国自然科研课题1项,吉林省科技厅科研课题6项,获吉林省科技厅科技进步三等奖1项,SCI论文4篇。国家级论文20余篇。





 京公网安备 11010502033352号
京公网安备 11010502033352号