乳腺癌是全世界女性最常见的恶性肿瘤,2018年全球有约210万例新诊断的女性乳腺癌病例,约占女性癌症病例的1/4,严重威胁着女性的生命健康。我国乳腺癌发病率年增幅速度是世界平均水平的2倍,且年轻患者较多,中位发病年龄在45岁~55岁,约有60%的患者在诊断时仍为绝经前状态。中国绝经前女性乳腺癌早期患者中50%~60%为激素受体阳性,接受药物或者手术/放疗的卵巢功能去势作为内分泌治疗降低这类患者复发和进展风险的重要手段。正常情况下,下丘脑分泌的促性腺激素释放激素(GnRH)可刺激垂体分泌卵泡生成激素(FSH)和黄体生成激素(LH),进而刺激卵巢分泌性激素,构成下丘脑-垂体-卵巢调节系统。当外源性GnRH类似物(GnRHa)占据了垂体的GnRH受体后,垂体无法对正常GnRH反应,阻断了下丘脑-垂体-卵巢轴,导致卵巢激素分泌减少至绝经后水平,从而达到了抑制雌激素依赖性肿瘤的生长。
此外,部分绝经前患者(无论激素受体状态如何)有减少卵巢衰竭、提高生育率或降低过早绝经风险,因此药物卵巢功能抑制具有一定的优势。
对卵巢功能抑制(OFS)治疗这部分患者的情绪变化、生活质量和性生活影响,临床常见的药物去势和手术去势之间是否存在差异,成为了临床实践中迷惑和尚无定论的问题。本研究开展多中心调研,针对临床应用药物OFS和卵巢切除术的乳腺癌患者的抑郁状态、生活质量和性生活质量进行评估。
研究纳入了从2019年6月至2020年6月来自全国7家三甲医疗机构的乳腺癌患者共计563例,药物OFS治疗患者389例,卵巢切除术患者174例,采用患者健康问卷(PHQ-9)对抑郁症患者进行评估,并用QLQ-BR23和FSFI女性性功能指数问卷对其进行生活质量和性功能评估。调研问卷咨询患者是否愿意接受其他方式的卵巢功能抑制,以期评估患者目前接受卵巢功能抑制方式的满意程度。
在这项横断面调查中,563名受邀者接受OFS治疗的患者完成了调查(调研回复率100%)。在这些患者中,174例接受了卵巢切除术OA,389例接受药物GnRHa治疗。表1列出了药物GnRHa和卵巢切除术OA队列的主要特征。
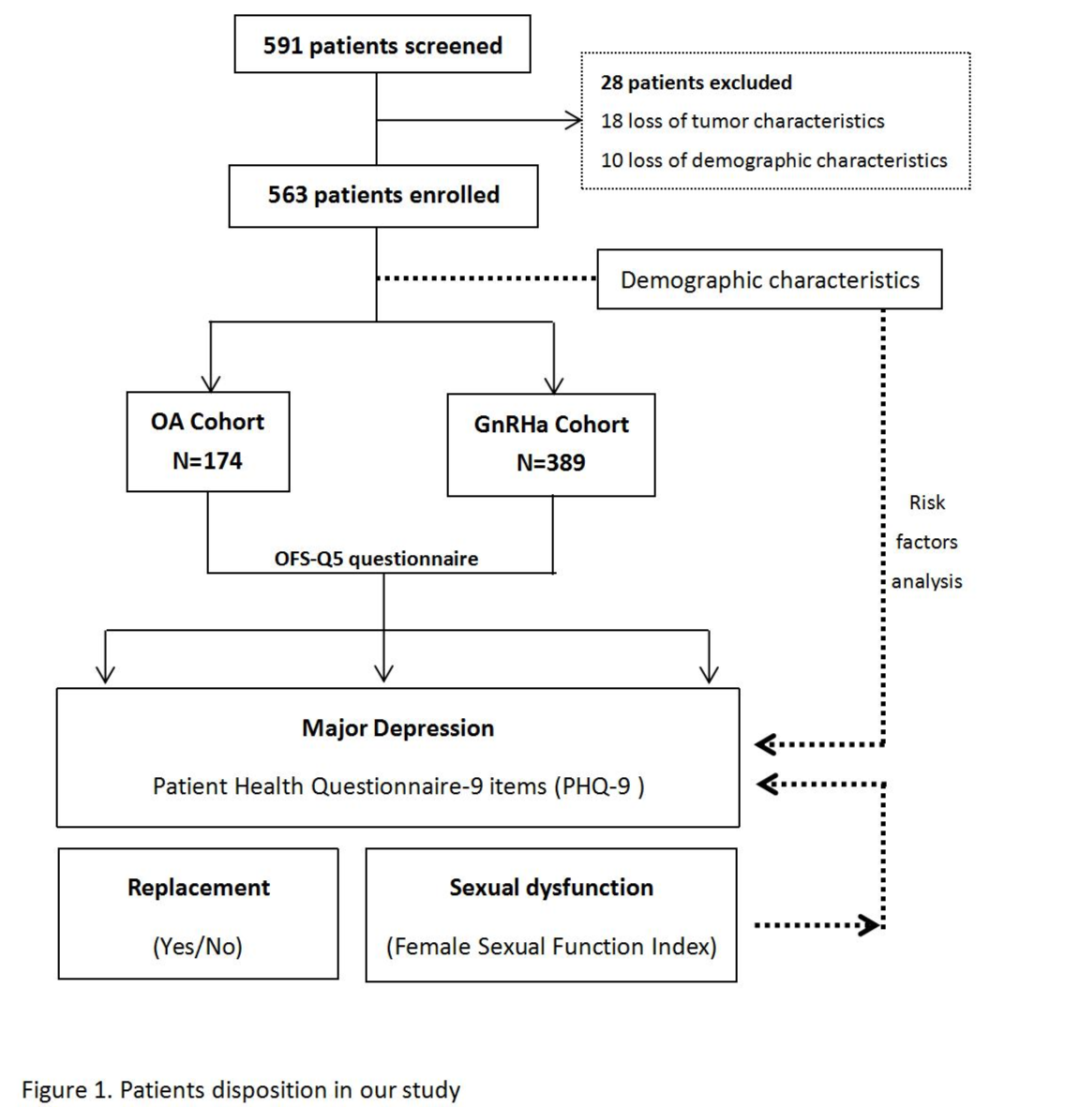
图1. 患者基线特征
?
卵巢切除术OA组和GnRHa组患者的中位年龄分别为46.0岁和43.0岁。表1显示,卵巢切除术OA组从卵巢抑制开始的时间间隔明显长于GnRHa组(30.3±31.2个月vs.22.8±22.2个月,P=0.009)。大多数受访者年收入较低(77.0%),从未吸烟或轻度吸烟(98.4%),很少饮酒或不饮酒(99.1%),无合并症(93.8%),接受过乳房切除术(77.3%),患有Ⅰ~Ⅲ期癌症(73.3%),雌激素受体或孕激素受体阳性癌症(97.2%),HER2阴性(76.1%)。此外,GnRHa队列中59.2%的患者受过大学或以上教育,而卵巢切除术OA队列的相应百分比仅为42.4%。值得注意的是,接受GnRHa的患者更倾向于保乳手术(26.0%vs.16.7%,P=0.015)。
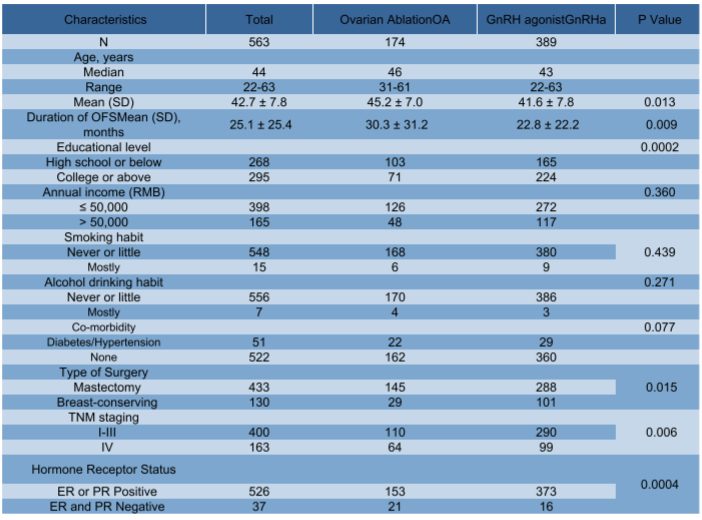
结果显示,包括戈舍瑞林在内的药物去势组的重度抑郁发生率显著低于卵巢切除术OA组(31.1% vs 40.2%,P=0.025,PHQ-9≥15定义为重度抑郁),两者差异具有统计学意义。PHQ-9总分平均值略低于卵巢切除术OA组(11.4±5.7 vs.12.8±5.8,OR=1.910,P=0.079),两者无明显差异统计学差异。
药物去势组出现自杀意念的比例与卵巢切除术OA组相似(8.6%对比7.7%,P=0.713)。
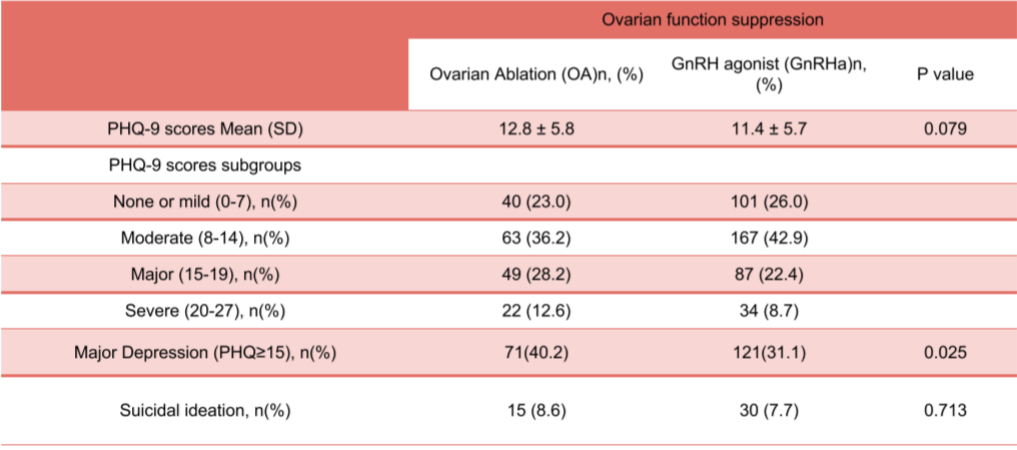
接受GnRHa的患者的FSFI平均值和中位数均低于卵巢切除术OA患者(平均值:17.8±8.7 vs.19.3±8.5,P=0.205;中位数:17.8 vs.19.6)。性功能障碍(定义为FSFI<23)的结果显示,证据表明GnRHa可引起一定程度的性功能障碍,61.5%的卵巢切除术OA患者符合性功能障碍的标准,而接受GnRHa治疗的患者中有72.2%符合性功能障碍的标准(P=0.011)。与接受卵巢切除术OA的患者相比,接受GnRHa治疗的患者在大多数FSFI子评分中的得分略低。在疼痛部分的评分明显较低(FSFI-6评分:平均值±标准差:3.3±2.2 vs.2.5±2.2,P=0.007)。
在调查问卷的最后一部分,受邀者被问到:“你会选择换成另一种OFS吗?例如,您接受的卵巢切除术是否考虑更换为药物GnRHa治疗?或者您接受的药物GnRHa,是否考虑更换为卵巢切除术?“令人惊讶的是,两个队列中的大多数受访者都对这种转化持积极态度。大约62.4%的患者选择改变OFS的类型(药物GnRHa:62.7%,卵巢切除术OA:60.8%)。由于对成本的担忧可能会影响最终选择,我们将以下项目包括在内:“如果不考虑成本,您是否会选择更改为另一种OFS;例如,不考虑成本情况下,您接受的卵巢切除术是否考虑更换为药物GnRHa治疗?或者不考虑成本情况下,您接受的药物GnRHa,是否考虑更换为卵巢切除术?“在回答这个问题时,卵巢切除术组的更换率显著增加到70.3%,而药物GnRHa组的替代率没有显著提高(67.1%)。结果显示两个队列中的大多数受访者可能对他们目前的OFS解决方案不满意,因为抑郁、性功能障碍或总体生活质量下降。
该研究为首个多中心横断面调研,以探究不同卵巢功能抑制方式是否在抑郁症相关方面有所差异及可能影响因素。研究结果显示卵巢切除术较药物GnRHa更易出现重度抑郁。与其他使用不良事件通用术语标准(CTCAE)分级来评估OFS不良反应的研究不同,我们在研究中使用PHQ-9评分。Moore等发现早期乳腺癌患者的不良反应包括其OFS队列中8例2级情绪障碍和1例3级情绪障碍,而非OFS队列中有3例2级情绪障碍。在我们的研究中,使用PHQ-9问卷评估的重度抑郁症可以多维视角提供情绪障碍的情况。此外,大多数患者更愿意更换现行的OFS治疗方案,可能提醒我们应该从多维度关注患者卵巢功能抑制治疗的不良反应和依从性。因此,药物GnRHa成为了卵巢功能抑制的优选,具有作用可逆并可保留患者生育能力、不良反应低的优势。
1、Silvestris E, Dellino M, Cafforio P, et al. (2020) Breast cancer: An update on treatment-related infertility. J Cancer Res Clin Oncol 146:647–657. http://doi.org/10.1007/s00432-020-03136-7/2、Stuursma A, van Driel CMG, Wessels NJ, et al. (2018) Severity and duration of menopausal symptoms after risk-reducing salpingo-oophorectomy. Maturitas 111:69–76. http://doi.org/10.1016/j.maturitas.2018.01.0123、Lan B, Jiang S, Li T, et al. (2020) Depression, anxiety, and their associated factors among Chinese early breast cancer in women under 35 years of age: A cross sectional study. Curr Probl Cancer 100558. http://doi.org/10.1016/j.currproblcancer.2020.100558/4、Moore HC, Unger JM, Phillips KA, et al., POEMS/S0230 Investigators (2015) Goserelin for ovarian protection during breast-cancer adjuvant chemotherapy. N Engl J Me 372:923–932. http://doi.org/10.1056/NEJMoa1413204
辽宁省肿瘤医院副主任药师 硕士研究生导师
辽宁省“兴辽英才计划”青年拔尖人才
辽宁省百千万人才工程千层次人才
中国抗癌协会肿瘤标志专业委员会 青年委员
中国抗癌协会肿瘤标志专业委员会乳腺癌协作组 委员兼秘书
中国临床肿瘤学会(CSCO)转化医学专家委员会委员
中国研究型医院精准医学与肿瘤MDT专业委员会 委员
辽宁省药学会抗肿瘤药物专业委员会 秘书长
辽宁省肿瘤医院乳腺内科主任、博导
辽宁省肿瘤医院临床试验机构办公室主任
辽宁青年名医、省优秀科技工作者、省青年科技奖获得者
辽宁省政府授予“辽宁省百千万人才工程百层次人才”
中国临床肿瘤学会(CSCO)乳腺癌专业委员会常委
中国临床肿瘤学会(CSCO)肿瘤心脏病学专家委员会副主任委员
中国抗癌协会肿瘤标志物专业委员会常委
中国抗癌协会多发和不明原发肿瘤专业委员会常委
中国老年学和老年医学肿瘤康复分会副主任委员
中国研究型医院精准医学与肿瘤MDT专业委员会副主任委员
辽宁省抗癌协会肿瘤标志物专业委员会主任委员
辽宁省抗癌协会化疗专业委员会(候任)主任委员





 京公网安备 11010502033352号
京公网安备 11010502033352号