本研究旨在评估泽布替尼在R/R MCL治疗中的持续有效性和安全性。在该单臂、多中心2期试验(NCT03206970)中,患者持续口服泽布替尼(160mg,每日两次)直至PD或出现不能耐受的毒性。前96周每12周,之后每24周进行一次疗效评估,采用2014 Lugano标准。研究目标包括ORR率(研究者评估的PR及以上疗效),DOR,PFS,OS,以及安全性。
研究结果显示中国13家研究中心共入组86例患者。中位年龄60.5岁,83.7%为MIPI-b评分中/高危患者。大多数患者分期晚,90.7%为III/IV期。45.3%存在骨髓侵犯,70.9%存在结外侵犯。>10cm和>5cm的大包块分别见于8.1%和43.0%的患者。中位前期治疗线数为2线(范围,1-4线),52.3%的患者为难治性疾病。
截止至2020年8月,中位随访时间为35.3个月(范围0.3-41.6个月),45.3%的患者仍在继续服用泽布替尼治疗,54.7%的患者因PD(43.0%)或不良反应(9.3%)终止了治疗。ORR为83.7%,67例患者(77.9%)达到了CR。中位DOR尚未达到,30个月时57.3%(95%CI,44.9-67.9)的患者处于无事件(PD/死亡)生存。中位PFS为33.0个月(图A);疗效在各种亚组分析中均一致(MIPI-b,前期治疗,难治状态等)。中位OS尚未达到(图B)。
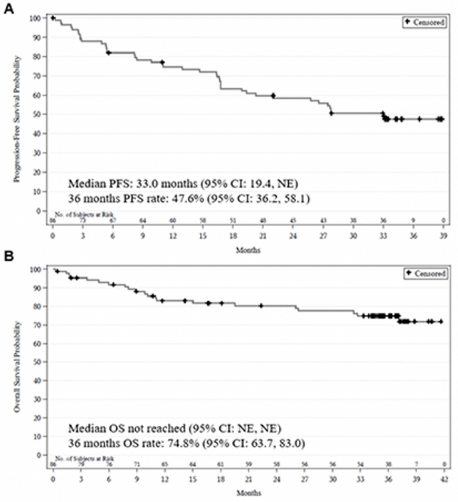
图1:(A)PFS,(B)OS
安全性分析结果和前次随访结果高度相似。最常见的(≥20%)治疗相关不良事件(TEAE)包括NEUT减少(46.5%),上呼吸道感染(38.4%),皮疹(36.0%),WBC减低(33.7%),以及PLT减低(32.6%),多数为1/2级。
≥3级的TEAE(≥5%)包括NEUT减低(18.6%),肺炎(12.8%),PLT减低(7.0%),WBC减低(7.0%),以及贫血(5.8%)。多数AE发生于泽布替尼治疗的初期阶段,此次随访阶段新发AE很少见。4例患者发生了≥3级任何部位感染的TEAE(共计18.6%,所有级别65.1%),无新的患者发生≥3级高血压(共计3.5%,所有级别16.3%)或严重出血的TEAE(严重/3级出血或任何级别的中枢神经系统出血;共计3.5%)。
整个研究期间,无病例发生房颤/房扑,≥3级的心脏AE,第二原发肿瘤,以及肿瘤溶解综合征。无新的导致死亡的TEAE(共计8.1%),治疗中断(共计9.3%),或剂量减低(共计2.3%);在此随访期间有3例新发剂量中断(共计18.6%)。
泽布替尼是百济神州自主研发的抗癌新药,为二代强效BTK抑制剂,经过分子结构的优化,能对BTK靶点形成完全、持久的精准抑制,同时减少了脱靶效应及相关不良反应的发生。泽布替尼于2019年11月经FDA批准以“突破性疗法”的身份,优先评审在美国获批上市。2020年6月,泽布替尼在中国获批上市,用于治疗既往至少接受过一种治疗的成人MCL及CLL/SLL。2020年12月,泽布替尼已进入中国医保目录。
泽布替尼单药治疗R/R MCL的单臂、多中心临床研究是一项关键2期临床研究,中位随访时间从18.4个月延长至35.3个月,历经近3年的时间,再次证实了泽布替尼单药在R/R MCL中良好的有效性和安全性。尽管该研究入组患者中,难治患者比例和MIPI-b中高风险比例均高于伊布替尼3期研究RAY研究,但中位随访近3年时仍有高达45.3%的患者仍在继续服用泽布替尼治疗, ORR为83.7%,CR率77.9%。中位PFS为33.0个月,中位OS未达到。无论是CR率还是中位PFS都较前次随访进一步提升,并且疗效在各种亚组分析中无差异。
在安全性方面,此次随访阶段新发AE很少见,仅观察到4例患者发生了≥3级任何部位感染的TEAE,无新发≥3级高血压或严重出血。整个研究期间,无病例发生房颤/房扑,≥3级的心脏AE,第二原发肿瘤,以及肿瘤溶解综合征。无新的导致死亡的TEAE,无新发治疗中断或剂量减低。因此进一步证实多数AE发生于泽布替尼治疗的初期阶段,总体上安全性良好。
总之,泽布替尼作为二代强效BTK抑制剂,在R/R MCL患者治疗中具有良好的有效性和安全性。泽布替尼作为单药或与其它疗法联合用药,在其它多种淋巴瘤中也在开展临床研究,为淋巴瘤患者带来了新的治疗选择。
主任医师 博士生导师
北京大学肿瘤医院党委书记、大内科主任、淋巴瘤科主任
中国临床肿瘤学会(CSCO)常务理事
中国抗淋巴瘤联盟主任委员
中国免疫学会血液免疫分会副主任委员
中国老年学会老年肿瘤专业委员会常委
主要专注于恶性淋巴瘤诊断治疗